1.GAMP5与21 CFR Part11概念
(1)为什么遵循GAMP5?
GAMP5提供一种经济的(低成本的)良好实践框架,以此确保计算机化系统符合预定用途并遵从适用的法规要求。该框架的目标是保证患者安全,产品质量及数据完整性,同时它也会给企业带来经济利益。该指南还为生命科学领域的供应商提供了基于良好实践要求的系统开发与维护方面的指导。
(2)为什么遵循21 CFR Part 11?
FDA要求和应用
GAMP5并未强制要求电子记录/签名,但电子记录已然是当前的流行趋势
符合优良质量管理的要求
附PART11网址:
http://www.accessdata.fda.gov/scripts/cdrh/cfdocs/cfcfr/cfrsearch.cfm?cfrpart=11
2.GAMP与达成21 CFR Part 11合规
GAMP指南中提供了要满足当前关于电子记录和电子签名合规的监管要求的及时和急需的方向。该指南介绍了风险管理的方法,通过对记录和记录相关的风险采取适当的控制,可以用来确保受监管的电子记录和电子签名的合规性。
良好遵循GAMP5进行设计的自动化系统,兼备达成21 CFR Part 11合规。
3.GAMP5文件结构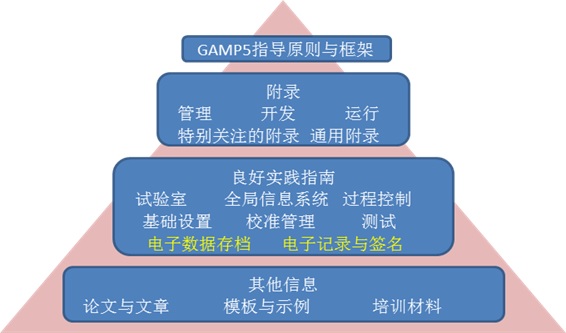
4.电子记录的概念
电子记录的引入有助于规范生产管理,并有效提高质量管理系统的稳定和运作效率,切实关系到企业GMP的实施效果。
所谓电子记录,是指依靠计算机系统进行创建、修改、维护、存档、找回或发送的诸如文字、图表、数据、声音、图像及其他以电子形式存在的信息的任何组合。此外,与之密切相关的另外一个概念是电子签名,指计算机对一些符号的执行、采纳或者被授权的行为进行数字处理,使这些行为在法律上完全等效于传统个人手工签名的行为。
5.电子记录的分类
(1)在药品生产各环节的操作人员手动录入数据形成的记录,这种记录的一部分是论文文集基础数据,另一部分是一些现阶段不能实现自动采集的数据,必须经由操作人员手动从终端录入的。
(2)计算机化系统自动生成的记录,其中包括生产线或其它控制设施自动采集的数据形成的记录;也包括根据基础数据生成的数据,如计算机系统会根据基础数据在生产计划下达后,自动生成的物料需求计划。
(3)将记录或记录的信息加工整理后以电子形式储存归档形成的档案,如用专用软件取代Windows资源管理器来管理GMP文件时所涉及到的记录类档案。被整理归档保存之前,这些被加工整理的记录有可能属于上述第(1)类和第(2)类的两种情况,也有可能是非电子形式的纸质记录。
6.电子记录的优势
(1)与传统纸介质记录相比,电子记录具有以下优势:
第一,采集的数据更完整,如生产报警信息、配方参数更改记录,这与传统的手工记录相比要更完整和准确,更有利于工艺改进和产品质量的追溯。
第二,数据易进行统计分析。
GMP记录是我们进行质量追溯,对质量系统进行分析和持续改进的重要依据。对于纸介质记录,我们需要通过一系列的手段对其包含的信息进行处理和加工,进而得出结论或发现问题。而这个处理和加工的过程很多情况下本身是程序化的,使用计算机化系统之后,处理的过程可以完全由系统来完成,计算机化系统自动采集的数据被汇总之后直接由相应的软件来处理,省时省力。
第三,检索方便快捷。
记录的检索应该方便快捷,数量和类别较少的情况下我们可以方便快捷地检索传统的GMP纸介质记录,而一旦企业记录的种类和数量较多之后,记录的管理和检索就成为十分繁琐的工作.对于那些将电子签名也良好地应用起来的企业的计算机化系统,访问人被赋予一定权限之后,可以在权限范围之内对所有电子记录和处理结果进行访问和检索,十分方便。
(2)GAMP5原文摘录:
ACAT具备完备的电子批记录组件包和应用经验,可与各组态系统集成,适合各设备厂家配备与改造。
如有需要,请详询销售工程师。